今天為廣大朋友介紹的是——染料廢水處理技術
近年來,水污染日益嚴重,而目前傳統的水處理方法難以處理水體中難降解的有機物(如染料和藥物等)。因此,越來越多的學者研究了許多新方法來解決難降解有機物造成的水污染問題。染料在染色、涂料、顏料和紡織等領域被廣泛使用,是造成水污染的一大原因。染料的化學結構復雜、有生物毒性且難于用傳統的方法降解。亞甲基藍(methylene blue , MB )作為一種偶氮染料在印染和紡織工業中應用廣泛,因而被廣泛的研究。
高級氧化技術(advanced oxidation processes , AOPs)作為難降解有機廢水的一種有效的處理方法,近年來受到越來越多的關注。 AOPs是一種基于輕基自由基(·OH)氧化的技術,·OH具有僅次于氟的氧化勢(2. 80 eV ),幾乎可以無選擇性氧化所有有機物,直至將有機物礦化成H2O,CO2和無機鹽。目前,研究比較廣泛的AOPs有光催化、 Fenton、光催化臭氧化、等離子體等,以及它們的協同技術。
等離子體尤其是低溫等離子體技術,能原位產生·OH、H2O2、O3 、HO2·和·O等高能電子等活性物質,同時伴隨著液電空穴、沖擊波和紫外光輻射等物理效應。該技術是集多種AOPs的優點于一身的高級氧化技術。介質阻擋放電(dielectric barrier discharge , DBD)等離子體是低溫等離子體的一種,具有電子密度高、放電均勻穩定等特點,受到廣泛的重視。DBD反應器是在放電空間中插入絕緣介質的放電反應器,主要有板一板式和線一環式2種形式。阻擋介質即可以覆蓋在電極表面,也可懸掛于放電空間中,形成電子密度較高的、均勻穩定的放電。
采用新型的雙氣室DBD等離子體反應器降解MB溶液,與傳統板一板式DBD放電反應器相比,新設計的反應器增加了曝氣,同時增加了一個氣室。當兩電極之間施加高壓電時,放電在上、下氣室同時發生,活性物質在兩個氣室和溶液中產生。產生的活性物質可以同時處理液層上下兩個表面的有機物,同時由于曝氣的作用,下氣室產生的氣體(主要是臭氧、含氮的氧化物)必須要經過溶液才能離開反應器,增加了活性氣體在溶液中的停留時間,同時加強了氣液相傳質。本文研究了在新型雙室DBD等離子體反應器中,液體體積、下氣室高度、輸入功率、初始pH、初始濃度和曝氣種類對亞甲基藍降解效率和溶液COD的影響。同時分析了MB的降解產物,初步提出了MB的降解機理。
一,實驗部分
1. 1實驗裝置
實驗采用圖1所示的石英DBD反應器,外徑140mm,內徑134 mm,高度100 mm,底板厚2 mm,內部有4個長度為15 mm直徑為6 mm的石英柱8固定在反應器內壁用來支撐曝氣板。反應器壁上有2個石英制成的進氣管3,實驗氣體(空氣,O2)由2個進氣管進入反應器。
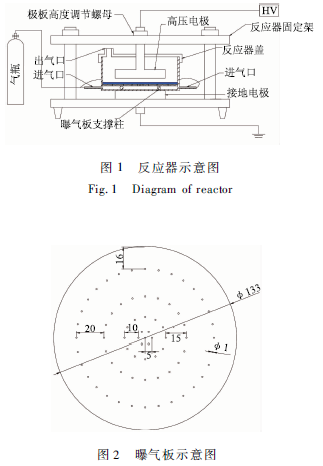
O2作為工作氣體時,通氣后加入溶液,蓋好蓋子后持續通氣,用氣相色譜分析出氣日處氣體,直至檢測不到N2(30 min)再開始放電反應。反應空間用有機玻璃制成的蓋子與外界分離。電極是由兩塊直徑90 mm的不銹鋼板制成,兩電極分別與交流電源(15 kV/100 V)連接。與傳統的平板DBD反應器不同的是在設計的反應器中液體不直接與接地電極表面的阻擋介質接觸而是用一塊如圖2所示的多孔的有機玻璃板將溶液與接地電極分離。實驗時先通入氣體,然后再注入待處理溶液,蓋上蓋子,形成上下兩個氣室,電極間距用支架上的螺母調節。
傳統的板一板式DBD反應器只具有一個放電空間,自然封閉的空氣放電,無氣體流動,等離子體產生的活性物質由于傳質阻力無法到達液相主體,尤其是短壽命的自由基至多只能到達液層以下2 mm處。因此,傳統DBD反應器只能處理液體表層的有機物,受擴散影響很大。與傳統板一板式DBD放電反應器相比,新設計的反應器增加了曝氣,同時增加了一個氣室。當兩電極之間施加高壓電時,放電在上、下氣室同時發生,活性物質在兩個氣室和溶液中產生。產生的活性物質可以同時處理液層上下2個表面的有機物,同時由于曝氣的作用,下氣室產生的氣體必須要經過溶液才能離開反應器,增加了活性氣體在溶液中的停留時間,同時加強了氣液相傳質。
1. 2試劑、儀器及分析方法
1. 2. 1實驗試劑
亞甲基藍(BS,科密歐),HR S04 ( AR,江天),NaOH ( AR,光復),重鉻酸鉀(AR,光復),硫酸亞鐵錢(AR,光復),硫酸銀(AR,光復),鄰菲鑼琳(AR,光復),Nat S04 ( AR,光復)。
1.2.2實驗儀器
紫外可見分光光度計(LS S,上海儀電分析儀器有限公司),pH計(pHS-3 C,雷磁),電導率儀(DDS-11C,雷磁),質量流量控制器( D07-7A/ZMM,北京建中機器廠),流量顯示儀(D08-4C/ZM,北京建中機器廠),電子天平(AL204,梅特勒一托利多儀器有限公司),高壓變壓器(15 kV/100 V,50 Hz,青縣同科電器制造有限公司),氣相色譜質譜聯用儀(CCMS) ( Agilent 5977A MSD, Agilent 7890B CC System, Agilent Teoh-nologies ),液相色譜質譜聯用儀(LCMS) ( LCQ Deoa XP MAX, Thermo Fisher) 。
1.2.3分析方法
用電子天平稱取0. 1 g的MB固體用去離子水定容到100 mL,制成濃度為1 g / L的MB儲備溶液,根據實驗需要,分別稀釋成濃度為50 、 100和200 mg / L 的MB實驗溶液,實驗為間歇操作。采用紫外可見分光光度法與采用高效液相色譜法都可以準確的表示MB的濃度變化。本實驗采用紫外可見分光光度法測量MB的濃度,由標準曲線可知MB的濃度在10 mg / L以下符合朗伯一比爾定律,因此每次測量都取出1 mL的溶液稀釋相應的倍數,在比較大吸收波長664 nm下測量吸光度,MB的脫色率DE用(1)式計算。空氣曝氣時取樣間隔20 min,氧氣曝氣取樣間隔5 min。有機物的礦化用COD的脫除率間接測量。COD采用重鉻酸鹽法測量(GB 11914-89 ) , COD脫除率ME用式(2)計算。降解MB的能量效率Y用(3)計算。pH用稀硫酸H2SO4(0.2 mol / L)和NaOH溶液(0. 2 mol / L)調節。氧氣DBD等離子體處理15 min后的產物用CCMS和LCMS分析。
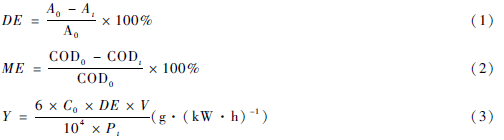
式中:A0為溶液的初始吸光度;A為處理時間為t時溶液的吸光度;V為處理液體的體積(mL);P為輸入功率(w);t為處理時間(min ) ; C0為溶液的初始濃度(mg /L) ;COD0為初始化學需氧量(mg /L'),CODt為處理時間為t時的化學需氧量(mg /L)。
二,結果與分析
2. 1處理液體積(液層厚度)對MB降解的影響
實驗采用初始濃度為50 mg /L、初始pH為4. 0、初始電導率為84 μS /cm的MB溶液,空氣流量60 SCCM,輸入電壓6 kV,輸入功率18 W,高壓電極與液面間距(上氣室高度)7. 5 mm,下氣室高度7 mm處理液體積對脫色率和能量效率的影響如圖3所示,隨處理液體的體積增加MB的脫色率下降,但能量效率卻升高。
液層的厚度隨處理液體的體積增加而增加,等離子體中的短壽命活性物質尤其是·OH(3.7 x 10-9 s)只能到達液體表面,未能與液體內部有機物充分接觸,導致MB的脫色率較低。但對于較多的溶液,由于溶液中含有的MB分子數量較多,溶液濃度隨時間變化較慢,MB分子與放電空間中產生的活性物質發生碰撞的機會較大,能量效率較高。但體積多的溶液中MB分子的數量較多,雖然能量效率有所提高(即溶液中MB分子降解的絕對量增加),但溶液多時MB分子的總數也多,因此,MB溶液的脫色率卻下降。
Y隨降解時間的增加達到比較大值后下降,處理50 mL溶液時,能量效率在40 min時達到比較大值,而處理100 mL溶液時,能量效率在80 min時達到比較大。在少量的溶液中,MB分子可以在較短的時間內被降解,隨溶液中MB濃度下降,中間產物的濃度增加,等離子體產生的活性物質與MB碰撞、反應的機率降低,因此能量效率下降較快。而溶液較多時,濃度變化較慢,隨放電時間增加溶液中MB的濃度下降,中間產物的濃度升高,達到一定值時,能量效率也隨即下降(80 min )。為了獲得較高的脫色率,本文選擇溶液的體積為50 mL。
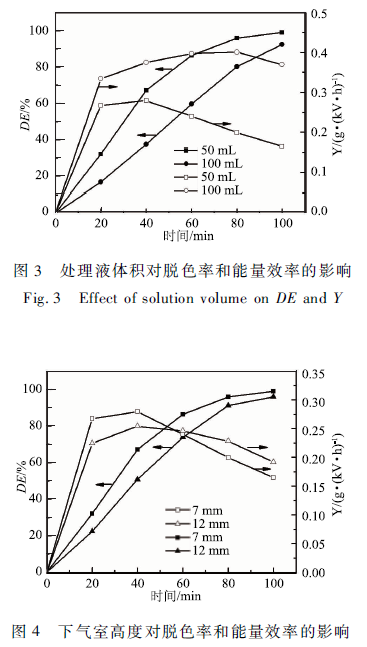
2. 2下氣室高度對MB降解的影響
實驗采用初始濃度為50 mg / L 、體積50 mL、初始pH為4. 0,初始電導率為84 μS /cm的MB溶液,空氣流量60 SCCM,輸入電壓6 kV。為了保證穩定放電,上氣室高度固定7. 5 mm。研究下氣室高度分別為7 mm , 12mm對MB的脫色率和能量效率的影響。由圖4可知,隨下氣室高度增加MB的脫色率下降,但能量效率先下降后升高。
一方面,電極間距加大,放電空間內的電場強度下降,在輸入電壓相同的條件下,下氣室高度從7 mm增加到12 mm,輸入功率從18 W下降到15 W。輸入電能減少,使放電空間中活性物質減少,導致脫色率和能量效率下降。
另一方面,電極間距增大使更多能量用于形成等離子體隧道。電極間距較大時,等離子體隧道較長,隨放電時間增加,反應空間內溫度和濃度梯度增大,導致活性物質(自由基、激發態分子、原子)在放電空間內重新組合、淬滅。活性物質在反應空間內的重新組合雖然可以增強物理效應(紫外光的強度),但非平衡等離子體對有機物的降解作用主要是化學效應的作用,過多的物理效應對MB溶液的降解起不到明顯的作用。因此,電極間距較大的反應器中MB的脫色率較低。但隨反應進行,放電空間內MB的濃度降低,雖然電極間距較小時,放電產生的活性物質的濃度較高,但此時MB的濃度較低,與活性物質碰撞反應的幾率下降,此時下氣室高度不同導致的脫色率的差別減小。而輸入電壓相同時,電極間距較大的反應器的輸入功率較低,由式(3)可知,在脫色率差別較小時,輸入功率下降將導致能量效率升高。因此,在反應后期電極間距較大的反應器的輸入功率較小使能量效率的計算值較高。
另外,隨著反應進行,溶液的電導率從初始的84 μS /cm升高到3. 01 mS / cm ( DBD處理100min,電導率的升高使電場強度進一步下降、等離子體隧道難于形成、活性物質的濃度也進一步下降。由于電極間距較小的反應器中電場強度、活性物質的濃度較高,電導率上升導致的削弱作用較明顯,此時由活性物質濃度下降導致的MB的脫色率下降和輸入功率較大共同導致能量效率計算值急劇下降,此時(放電60 min后),電極間距較小的反應器的能量效率計算值小于電極間距較大的反應器。在放電前60 min,下氣室高度為7 mm的反應器中MB的脫色率和能量效率都較高,且MB脫色率在下氣室高度為7 mm的反應器中一直較高。因此,選擇下氣室高度為7 mm。在HU等用等離子體降解果樂的研究中,也得到了相似的結果,果樂的降解率隨電極間距的增加而下降。
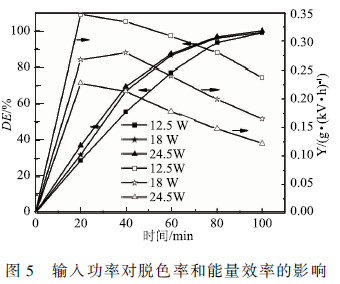
2. 3輸入功率對MB降解的影響
實驗采用初始濃度為50 mg / L 、體積50 mL、初始pH為4. 0、初始電導率為84 μS /cm 的MB溶液,空氣流量60 SCCM,上、下氣室高度分別為7. 5和7mm。通過改變輸入電壓5,6和7 kV,輸入功率分別為12.5 ,18和24. 5 W。如圖5所示,隨著輸入功率的增加,MB的脫色率增加,但能量效率下降。雖然增加能量的輸入有利于MB的快速降解,但能量耗散的也較多。這是由于輸入功率增加,容易產生火花放電,更多的能量用于產生熱量,導致溶液溫度上升。同時溫度上升會加快自由基的淬滅,使能量效率下降。因此,輸入功率的選擇需要權衡降解速率和能量效率。由圖7可知,放電處理60min時,輸入功率從12. 5 W提升到18 W MB的脫色率從77. 2%提升到86.5 %,輸入功率從18 W提高到24. 5 W脫色率僅提升到87.2%,但能量效率卻從0.24 g / (kW · h)下降到0.18 g / (kW · h)。因此,選擇輸入電壓6 kV,輸入功率為18 W可以合理地利用能量的同時獲得較高的降解率。
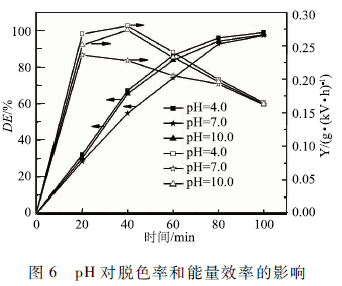
2. 4 pH對MB降解的影響
實驗采用初始濃度為50 mg/L、體積50 mL的MB溶液,空氣流量60 SCCM,上氣室高度7. 5 mm,下氣室高度7 mm,輸入電壓6 kV。改變初始pH分別為4.0,7.0和10. 0。在圖6中可以看出pH=4.0和pH = 10. 0時MB的脫色率和能量效率都較高,pH =4. 0的脫色率比較高。這是因為在本實驗中臭氧起到重要的降解作用,在酸性條件下臭氧的濃度較高主要發生臭氧的直接氧化反應,在堿性條件下主要發生通過輕基自由基(·OH)降解MB的間接氧化反應,而中性條件下,臭氧液相中的濃度較低。除此而外,pH會影響MB分子在水中的狀態,解離的濃度不同也會導致速率常數的差別。綜合以上因索,酸性和堿性條件下MB的降解率和能量效率都較高,pH為4. 0時降解效果比較好,選擇pH 4. 0為實驗條件。
2. 5初始濃度對MB降解的影響
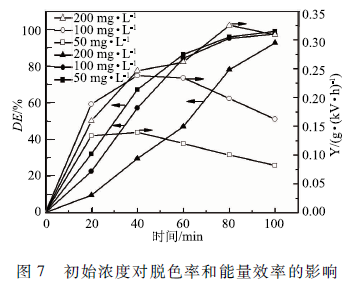
實驗采用50 mL初始pH為4. 0,初始濃度分別為50,100和200 mg/L ,電導率分別為84,150和200 μS /cm的MB溶液,空氣流量60 SCCM,上、下氣室高度分別為7. 5和7 mm,輸入電壓6 kV。如圖7所示,MB的脫色率隨初始濃度的增加而下降,而能量效率隨初始濃度的增加而升高。
一方面,隨初始濃度的增加,MB降解產生的中間產物的濃度增加。MB與中間產物都和等離子體產生的活性物質反應,但在相同的輸入功率下活性物質的濃度為定值,因此在高濃度的MB溶液中,脫色率較低,但由于高濃度的MB溶液中MB分子的數量較多,有更多的機會與活性物質發生作用,因此高濃度的溶液的能量效率較高。另一方面,隨著溶液濃度的增加溶液的透光性變差,降低了紫外光對溶液的作用,也是導致脫色率下降的另一原因。MACUREANU等在用DBD反應器降解己酮可可堿(pentoxifylline)的研究中也得到了相似的結果。
2. 6曝氣種類對MB降解的影響
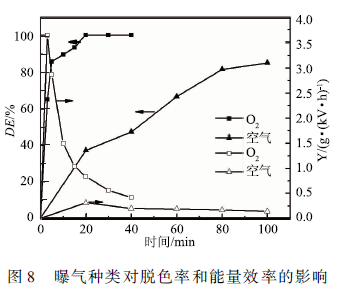
實驗采用初始濃度為100 mg/L,體積50 mL,初始pH為4. 0,電導率為150 μS /cm的MB溶液,分別采用空氣、O2曝氣,氣體流量60 SCCM,上、下氣室高度分別為7. 5和7 mm,輸入電壓6 kV。如圖8所示,氧氣可以在20 min內使MB的脫色率達到99. 98 %,而空氣需要100 min才能將MB脫色85.3 %。氧氣曝氣時,處理3min能量效率比較高,比較高可達3.63 g / (kW · h),而空氣曝氣時比較大能量效率在20 min時達到比較大,比較大能量效率為0. 31 g / (kW · h)。
一方面,由于反應器的電極間距較大,放電間距存在大量氣體,空氣中79% ( V/V)為N2 , N2的鍵能(9. 8 eV)大于O2(5.2 eV),解離N2要消耗比解離O2更多的能量。另一方面,從圖8可以看出,O2曝氣的能量效率比空氣曝氣的能量效率大一個數量級,這不僅僅是因為在空氣中解離N2要消耗較多的能量,更主要的原因是在空氣中大量的N2解離后與激發態的O反應,產生NOx(主要是NO和NO2 )。這一方面消耗了空氣系統中的氧氣,使O3等含氧活性物質的濃度下降,另一方面產生的NO·和NO2·在酸性條件下與·OH反應,產生過氧亞硝酸(HONOO) 。雖然過氧亞硝酸也有較高的氧化勢(2. 4 eV) ,但是由于過氧亞硝酸的形成消耗了氧化勢更高的·OH(2.80 eV),且HONOO容易異構成硝酸而失去強氧化能力,且導致酸性效應和電導率升高。
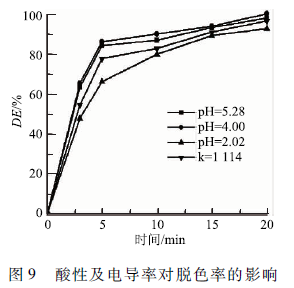
從2. 4的研究中可知酸性pH下MB的脫色率和能量效率都較高。為了進一步研究酸性的增加對MB降解的促進作用和NO的產生導致的反應中毒(含氧活性物質濃度的下降、電導率的升高)對MB的影響。在氧氣條件下,處理初始濃度為100 mg/L的MB溶液,分別調節MB溶液的pH為2. 02(空氣處理100 min時的pH為2. 07 ) 、4. 00和5. 28(不加硫酸的MB溶液的pH ),在pH為4. 00的溶液中加入硫酸鈉調節初始電導率(k)至1 114 μS / cm ,得到圖9。酸性增強對MB降解并不總是有利的,在pH從5. 28下降到4. 0時,MB的脫色率增加,但是當pH進一步下降到2. 02時,溶液的脫色率顯著下降。pH為5.28、4. 00和2. 02時溶液的電導率分別為64 、 150和4. 08 mS / cm 。強酸性條件不利于MB的降解,是由于電導率升高導致電場強度下降,等離子體隧道難于形成,活性物質濃度下降,從而導致的MB的脫色率在強酸性條件下較低。電導率升高導致的MB降解抑制效應,在加入硫酸鈉調節初始pH為4. 0的MB溶液的電導率k=1 114 μS / cm 降解MB溶液的實驗中,得到脫色率下降的結果中得到進一步的證實。因此,酸性的增強對MB降解的促進作用與酸性增強導致的電導率升高對MB降解的抑制作用相比較弱。因此,空氣曝氣時NOx的產生,導致的酸性效應并不能加強MB的降解,NOx的產生導致的反應中毒(氧化性物種中毒以及電導率升高等)是使MB的降解效率下降另一重要原因。
由于實驗采用的反應器有兩個氣室,氣體流速較低,放電產生的氣體在反應器中停留時間較長,因此,在空氣曝氣時反應中毒現象更加明顯。為避免氧化物中毒,采用O2曝氣,放電產生的含氧活性物質在反應器內也會累積,從而使脫色率和能量效率都有所提高。綜上所述,新設計的雙室DBD反應器不僅會加強氧氣放電的化學效應,增強氧化性物種的停留時間,同時也使空氣放電時反應中毒現象更加明顯。在DBD等離子體與活性炭協同降解五氯酚的實驗中,在1. 5 h等離子體處理后,在氧氣和空氣條件下的五氯酚的降解率分別為85%和78%。在新設計的雙室DBD反應器中,20 min的等離子體處理后,在氧氣和空氣條件下的MB的降解率分別為99. 98%和37. 39%。氧氣曝氣3 min時能量效率比較高,比較高能量效率可達3. 63 g / (kW · h) 。
HUANC等采用傳統的DBD,在pH為5. 68時處理40 min, MB溶液降解率達99. 79 % 。JI等用LiFe ( W04 ) 2作非均相Fenton試劑降解MB,在催化劑濃度10 g / L,過氧化氫濃度40 mmol /L , pH5.0,50 ℃時,200 mg/L的MB溶液處理100 min后降解率可以達到接近100% 。 KERKEZ等用負載Ag2O的TiO2在初始pH為5,可見光的條件下光催化處理MB溶液180 min,降解率比較高可達48. 90 %。但光催化、非均相Fenton反應都需要外加試劑,存在后續分離麻煩、處理成本高以及降解效果差等問題。雙室DBD反應器與傳統的平板DBD反應器相比,雖然在空氣曝氣時效率有所下降,但在氧氣曝氣時具有較高的能量效率,且不需要額外添加任何試劑。綜上所述,新型雙室DBD等離子體反應器在氧氣曝氣的條件下表現出突出的優勢,能以較高的能量效率有效的降解MB溶液。
2. 7不同曝氣種類對MB礦化的影響
實驗采用初始濃度為100 mg/L,體積50 mL,初始pH為4. 0,電導率為150 μS / cm的MB溶液,分別采用空氣、O2曝氣,氣體流量60 SCCM,上、下氣室高度分別為7. 5和7mm,輸入電壓6 kV。考察分別在空氣和O2的氣氛條件下,ME隨時間的變化,結果如圖10所示。在空氣曝氣100 min后COD脫除率僅達到54. 61 %,而O2曝氣40 min后COD脫除率就可以達到69. 78%。反應體系中O2曝氣可以產生大量的O3、H2O2和·OH等含氧活性物質。尤其是O3,在氧氣曝氣時,在放電作用下,下氣室中O3的濃度較高,相當于一個臭氧發生器,與上氣室的液相表面放電等離子體發生協同作用;同時,下氣室的氣體離開反應器一定要經過MB溶液,因此U3在液相中的的停留時間增加,使COD的脫除率提高。但在空氣曝氣條件下,放電產生大量的NOx(主要是NO和NO2)積聚在下氣室,與產生的含氧活性物質(主要是·O,·OH,H2O2和O3)反應,此外,NOx的形成消耗了系統中的氧減少了系統中含氧活性物質的濃度,由于含氧活性物質比NOx更能有效的降解MB分子。因此,在空氣曝氣時,降解和礦化效果較差。
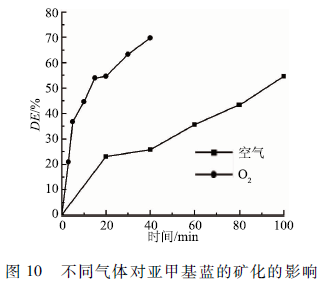
與圖8中的DE隨時間的變化曲線對比可知,MB的礦化比降解要慢許多。這是由于MB經過一系列的復雜的反應,生成許多有機中間體,由于MB分子相對容易被氧化,而生成的有機中間體比MB分子結構更加穩定,這些中間體與反應系統中的活性物質反應被降解的難度加大。因此,反應物系中有機物的礦化比MB的脫色更加困難,礦化速率相對較慢。
2. 8 MB降解產物及機理分析
氧氣等離子體處理MB溶液15 min后,得到的溶液用GCMS和LCMS分析,檢測到的中間產物如圖11和12所示。根據已有研究和前面結果推斷,MB分子的降解主要通過3種途徑:高能電子攻擊、臭氧氧化和輕基化。
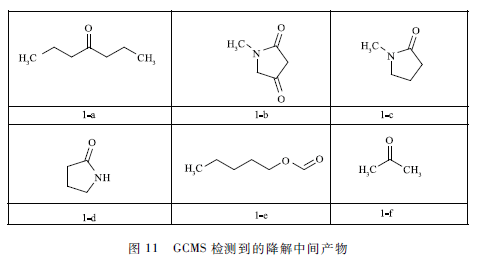
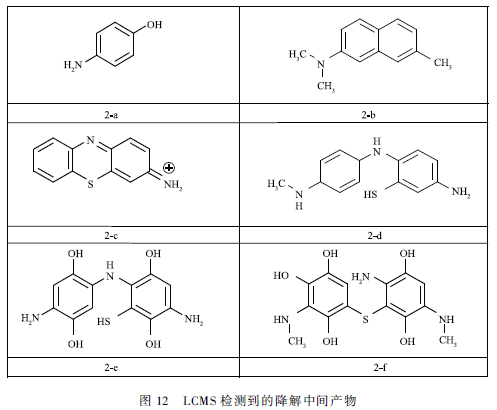
通過電子攻擊不斷的脫甲基,隨后開環,MB分子從雜環化合物先降解為芳香化合物再開環成為脂肪化合物,直至比較終礦化。產物2-c主要是電子攻擊MB,導致MB分子脫甲基化形成的產物。輕基自由基攻擊則是·OH不斷攻擊芳環,MB分子從復雜的雜環化合物先分解為脂肪化合物再降解為更小的分子,比較終礦化。產物2 -e和2 -f主要是由MB分子輕基化形成的。臭氧直接氧化,主要路線是通過Criegee機理,O3攻擊有機物的不飽和鍵形成三氧環狀中間體,隨后三氧環狀中間體分解成碳基化合物(竣酸、醛和酮)和CO2,但形成的有機酸、酮和醛難于通過臭氧直接礦化。GCMS檢測到的圖11中的產物主要是由O3直接氧化產生的。綜上所述,我們認為MB的降解是脫甲基化、輕基化和臭氧氧化協同作用的結果。
三,結論
本研究采用一種新型的雙室DBD反應器對MB溶液進行降解,MB的脫色率隨處理液體積增加,初始濃度的增加,下氣室高度的增加,輸入功率的減小而下降。在弱酸性和堿性條件下MB的脫色率較高。DBD等離子體處理20 min時,O2的脫色率是空氣的4. 4倍,在MB初始濃度為100 mg / L ,體積50 mL,初始pH為4. 0,電導率為150 μS / cm,O2流量60 SCCM,上、下氣室高度分別為7. 5和7 mm,輸入電壓6 kV(輸入功率18 W)時,處理20 min后,MB幾乎脫色完全(99. 98 % )。放電40 min后COD脫除率可達69. 78 %,能量效率比較高(3 min )可達3. 63 g / (kW · h)。反應器在空氣和氧氣作為工作氣體時,雙室DBD等離子體反應器對MB的降解效果差別很大,在新設計的反應器中空氣放電的缺點(生成NOx導致反應中毒)和氧氣放電的優點(含氧活性物質濃度較高)都被加強了。通過對比,光催化、Fenton反應、傳統平板DBD放電反應器,新設計的雙室DBD反應器在氧氣為工作氣體時具有較大的優勢。同時,通過分析MB的降解產物,提出MB的降解是脫甲基化、輕基化、臭氧氧化協同作用的結果。

污水處理設備聯系方式:
銷售熱線:010-8022-5898
手機號碼:186-1009-4262





